آلزایمر به عنوان مدل تجمع پروتئین: چالش های خالص سازی پروتئین و کنترل کیفیت در زیست فرآیند
1-چرا «تجمع پروتئین» مسئله ای کلیدی است؟
تجمع پروتئین یعنی تشکیل خوشه ها، الیگومرها، فیبریل ها یا توده های ژل مانند از پروتئین هایی که باید در حالت محلول و پایدار باقی بمانند. این پدیده دو پیامد خیلی جدی دارد:
1-1-در بدن (اهمیت پزشکی): تجمع پروتئین می تواند منجر به بیماری های تخریب کننده عصبی مثل آلزایمر شود، چون پروتئین هایی مثل تاو (Tau) و آمیلوئید بتا (Aβ) از حالت طبیعی خارج شده و به ساختارهای سمی برای نورون تبدیل می شوند. این ساختارهای تجمع یافته می توانند به نورون آسیب بزنند، باعث از دست رفتن عملکرد سیناپسی و در نهایت مرگ نورونی شوند.
1-2-در صنعت زیستی (اهمیت فرایندی): در تولید داروهای پروتئینی، واکسن های پروتئینی یا توکسین های نوترکیب، همین تجمع می تواند بازده خالص سازی را پایین بیاورد، باعث افت پایداری محصول شود و حتی ریسک ایمن زایی (immunogenicity) در انسان ایجاد کند؛ یعنی بدن بیمار پروتئین درمانی را به عنوان «غریبه» ببیند و علیه آن آنتی بادی بسازد. این مسئله یکی از دردسرهای شناخته شده صنعت زیست دارو است. در واقع، همان فرایندی که سلول عصبی را در آلزایمر می کشد، می تواند خط تولید یک پروتئین درمانی را هم زمین بزند.
2- از نورون سالم تا نورون بیمار — نقش تاو و میکروتوبول
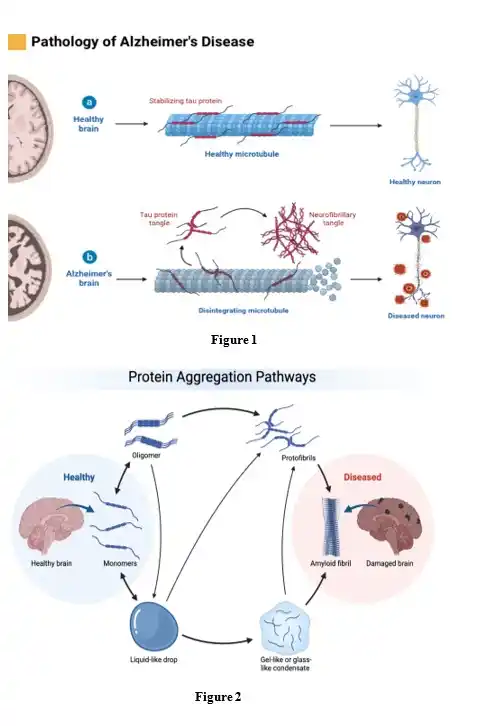
در شکل اول «Pathology of Alzheimer’s Disease» دو وضعیت مقایسه شده است:
الف) حالت سالم(Healthy brain)
در نورون سالم، پروتئین تاو روی میکروتوبول ها می نشیند و آن ها را پایدار نگه می دارد. میکروتوبول ها اسکلت درونی آکسون هستند و برای انتقال مواد، سیگنال دهی و زنده ماندن نورون حیاتی اند. یعنی تاو در حالت طبیعی مثل کمربند ایمنی میکروتوبول است. ثابت شده است که تاو یک پروتئین وابسته به میکروتوبول (Microtubule-Associated Protein) است که پایداری و سازمان یافتگی میکروتوبول را در نورون های سالم حفظ می کند.
ب) حالت بیماری(Alzheimer’s brain)
در مغز مبتلا به آلزایمر، تاو دچار هایپرفسفریلاسیون (hyperphosphorylation) می شود. فسفریلاسیون بیش ازحد باعث می شود تاو توان بستن و پایدار کردن میکروتوبول را از دست بدهد، از میکروتوبول جدا شود و شروع به تاخوردن نادرست(misfolding) و سپس تجمع کند. این تجمع ها ابتدا به «tangle»های تاو و در نهایت به توده های نوروفیبریلاری (neurofibrillary tangles) درون نورون تبدیل می شوند. این توده ها یکی از شناخته شده ترین امضاهای پاتولوژیک آلزایمر هستند و مستقیما با دژنراسیون نورونی، از دست رفتن پایداری اسکلت سلولی و مرگ نورون ارتباط دارند.
وقتی میکروتوبول بی ثبات شده و تجزیه شود (همان طور که در بخش پایینی شکل ۱ نشان داده شده)، آکسون دیگر نمی تواند ترافیک مولکولی خودش را نگه دارد و نورون وارد فاز بیمار (Diseased neuron) می شود.
3- مسیرهای تجمع پروتئین — از مونومر تا فیبریل آمیلوئیدی و کندانس قطره ای
شکل دوم «Protein Aggregation Pathways» مسیر کلی تری را نشان می دهد که فقط مخصوص آلزایمر نیست، بلکه یک زبان عمومی برای رفتار پروتئین های ناپایدار (از نورونی تا صنعتی) است.
گام ها:
1-3-مونومر (Monomer)
پروتئین در حالت تاشده ی عملکردی، محلول و قابل پیش بینی است. این همان وضعیتی است که ما در خالص سازی محصول هدف دنبالش هستیم.
3-2- اولیگومر (Oligomer)
اگر شرایط فیزیکوشیمیایی (pH، دما، غلظت پروتئین، یون ها، تنش برشی و … از محدوده تحمل خارج شود، بخشی از پروتئین باز می شود یا تاخوردگی اش ناکامل می ماند و چند مولکول با هم دست به دست می دهند و الیگومر می سازند. این حالت نیمه پایدار است، اغلب سمی تر، و اغلب همان نقطه ای است که بدن یا فرایند صنعتی شروع می کند به دردسر کشیدن. گزارش شده که در بیماری های عصبی، فرم های الیگومری تاو و آمیلوئید بتا (Aβ) می توانند از نورون جدا شوند، به نورون های دیگر بروند و یک پدیده شبه-بذرپاشی ایجاد کنند که به گسترش پاتولوژی کمک می کند.
3-3-پروتوفیبریل / فیبریل آمیلوئیدی (Protofibril → Amyloid fibril)
الیگومرها می توانند کنار هم ردیف شوند و الگوهای فوق منظم β-sheet تشکیل دهند که در نهایت به «فیبریل آمیلوئیدی» می رسد. این فیبریل ها پایدار، نامحلول و بسیار سخت برگشت پذیر هستند و در بافت مغز بیمار به صورت پلاک ها و توده ها دیده می شوند. این همان بخشی است که در شکل ۲تحت عنوان“Amyloid fibril → Damaged brain / Diseased” نمایش داده شده؛ یعنی مغز بیمار و نورون دژنره. فیبریل های آمیلوئیدی، امضای مولکولی بسیاری از نورودژنراسیون ها مثل آلزایمر محسوب می شوند.
4-3-مسیر جداگانه چگالش قطره ای (Liquid-like drop → Gel-like condensate)
نکته بسیار مهم و امروزی که در شکل ۲ دیده می شود، مسیر پایین است: پروتئین ها می توانند ابتدا در قالب «قطره های مایع مانند (Liquid-like droplets) از طریق پدیده جدایش فاز مایع-مایع (LLPS) جمع شوند، بعد این قطره ها کم کم سفت تر شوند و به ساختار ژل مانند یا شیشه مانند برسند، و در نهایت هم به فیبریل های پایدار و سمی تبدیل شوند.
یعنی همیشه لازم نیست از «محلول ، الیگومر ، فیبریل» برویم. یک مسیر جایگزین این است:
محلول ، قطره چگال شده (condensate) ، ژل/شیشه ، فیبریل.
این دقیقا همان چیزی است که کارهای ۲۰۲3 تا ۲۰۲۵ روی آمیلوئید بتا و تاو نشان داده اند: پروتئین می تواند اول داخل کندانس های LLPS غلیظ شود و بعد طی زمان پیر شود (aging) و به حالت آمیلوئیدی جامد برسد. این گذار «قطره مایع → جامد فیبریلی» الان یکی از داغ ترین مفاهیم در زیست فیزیک تجمع پروتئین و طراحی داروهای ضدتجمع است.
نکته طلایی برای ما در صنعت: این LLPS فقط در مغز رخ نمی دهد. در محیط های فرایندی با غلظت بالای پروتئین، نمک و برش مکانیکی، پروتئین های نوترکیب هم می توانند وارد این حالت قطره ای/کندانسه شوند و بعد در طول ذخیره سازی یا حین عبور از ستون، به ذرات نیمه جامد و در نهایت رسوب های مشکل ساز تبدیل شوند. این اتفاق یعنی گرفتگی ستون، افت بازیابی و ناهمگنی محصول.
4-چرا این پدیده در مقیاس صنعتی مهم است؟
حالا پل بزنیم از عصب شناسی به مهندسی فرایند.
پروتئین تراپی ها، واکسن های پروتئینی و توکسین های مهندسی شده همگی باید در حالت «مونومر پایدار» تحویل داده شوند.
اگر در طول بیان (upstream) یا خالص سازی (downstream) تجمع رخ دهد، چند فاجعه اتفاق می افتد:
- افت بازیابی: پروتئین در ستون می چسبد یا در فیلتر رسوب می کند.
- افت خلوص: الیگومرها و ذرات تجمعی در کنار فرم اصلی محصول می مانند و پروفایل SEC/HPLC را خراب می کنند.
- کاهش پایداری قفسه ای (Shelf-life): محصول زودتر دناتوره می شود.
- ریسک ایمنی زایی: بدن بیمار ممکن است این ذرات غیرطبیعی را «خطرناک» ببیند و سیستم ایمنی به آن پاسخ بدهد، که در بعضی کلاس های داروهای زیستی واقعا مشکل ساز است.
به بیان صنعتی: تجمع پروتئین می تواند محصول را از نظر رگولاتوری غیرقابل قبول کند، حتی اگر از نظر «فعالیت بیوشیمیایی» هنوز خوب به نظر برسد.
5- ما چطور این تجمع را می بینیم، اندازه می گیریم و می فهمیم؟
این جا سه لایه علم به هم می رسند:
پروتئومیکس، شیمی تجزیه تحلیلی، و بیولوژی مولکولی بیان ژن/پروتئین.
1-5-پروتئومیکس و جرم سنجی جرمی (Mass Spectrometry–based Proteomics)
پروتئومیکس بر پایهLC–MS/MS و تکنیک های با حساسیت بالا مثلPRM (Parallel Reaction Monitoring) وDIA، امروز می تواند:
- سایت های فسفریلاسیون تاو را نقشه برداری کند،
- ایزوفرم های فسفریله ی تاو را در مایع مغزی-نخاعی (CSF) و بافت مغزی مقایسه کند،
- و حتی تمایز بدهد که کدام فرم تاو می تواند به تنگل نوروفیبریلاری منجر شود و بنابراین به عنوان بیومارکر زودرس آلزایمر استفاده شود. این مطالعات در ۲۰۲۴ و ۲۰۲۵ گزارش شده اند و نشان داده اند که پروتئومیکس می تواند فرم های فسفریله ی تاو را به عنوان بیومارکر تشخیصی و پیش آگهی آلزایمر دنبال کند
این یعنی: با پروتئومیکس ما فقط «وجود پروتئین» را نمی بینیم؛ ما «وضعیت شیمیایی و ساختاری» آن را هم می فهمیم. و این برای تجمع خیلی مهم است، چون فسفریلاسیون نابجا در تاو باعث جداسازی آن از میکروتوبول و شروع تجمع می شود.
در صنعت زیستی هم همین منطق برقرار است. ما می توانیم در بچ های تولیدی، به صورت تحلیلی بررسی کنیم که آیا پروتئین اصلی ما (مثلا یک آنتی ژن واکسنی یا یک توکسین مهندسی شده) دچار تغییرات پس از ترجمه (PTM) یا برش های ناپایدار شده که آن را مستعد تجمع کند. این یعنی پروتئومیکس مستقیما وارد کنترل کیفیت می شود، نه فقط تحقیق پایه.
5-2-شیمی تجزیه تحلیلی و ابزارهای فیزیکی
اینجا می رسیم به ابزارهای کلاسیک و سخت افزاری شیمی تجزیه و بیوفیزیک:
- SEC-HPLC / SEC-MALS کروماتوگرافی ژل فیلتراسیون): برای جدا کردن مونومر از دایمر/الیگومر و بررسی درصد تجمع در محصول نهایی.
- DLS (Dynamic Light Scattering برای اندازه گیری قطر ذرات و دیدن تشکیل قطره های مایع مانند یا ذرات بزرگ در مراحل اولیه.
- CD وFTIR برای پیگیری تغییرات در ساختار ثانویه و سوم پروتئین تا بفهمیم آیا از حالت سازه ای سالم رفته به β-sheet غنی آمیلوئیدی یا نه). این دقیقا همان لحظه ای است که پروتئین در مسیر شکل ۲ از فرم «مایع مانند» به فرم «ژل/شیشه مانند» می لغزد.
این تکنیک ها پل می زنند بین علم پایه و مهندسی فرایند: ما می توانیم از تجمع پیش از این که در ستون کروماتوگرافی فاجعه بسازد، باخبر شویم.
3-5- بیان ژن و مهندسی بیان پروتئین
مسیر تجمع از همان لحظه ای شروع می شود که پروتئین در سلول (میزبان بیان) ساخته می شود. اکسپرشن خیلی زیاد یا خیلی سریع، نبود چپرون ها، یا جهش در توالی می تواند باعث تولید فرم های ناپایدار شود که مستعد الیگومریزاسیون و LLPS هستند.
بنابراین مهندسی بیان ژن — شامل انتخاب پروموتر مناسب، نرخ بیان کنترل شده، و حتی مهندسی توالی برای افزایش حلالیت — به طور مستقیم با میزان تجمع در مرحله پایین دستی (downstream) مرتبط است. این بخش هنوز به اندازه پروتئومیکس در منابع بالینی منتشر نشده، ولی در صنعت زیستی یک اصل پذیرفته شده است.
6-از تشخیص تا مهندسی کنترل: طراحی فرایند (DOE) و فضای طراحی
حالا سوال کلیدی برای یک واحد R&D یا QC این است: فقط بفهمیم که تجمع رخ می دهد، یا فعالانه جلویش را بگیریم؟
اینجا «طراحی آزمایش ها» (Design of Experiments; DOE) وارد بازی می شود. درDOE ما همه عوامل بالقوه موثر بر تجمع را باهم بررسی می کنیم — نه یکی یکی. این عوامل می توانند شامل pH بافر، دما، دبی جریان در ستون، زمان تماس پروتئین با رزین، قدرت یونی، و حتی غلظت پروتئین در هر مرحله باشند.
با اجرای طرح های فاکتوریل یا طرح های سطح پاسخ (Response Surface)، ما:
- محدوده های عملیاتی امن را تعریف می کنیم؛
- فضای طراحی (Design Space) را به دست می آوریم، یعنی بازه ای که در آن محصول مونومری پایدار می ماند و به سمت الیگومر و فیبریل نمی رود؛
- و پارامترهای بحرانی فرایند یا CPPهاو ویژگی های کیفی بحرانی یا CQAها را به صورت قابل دفاع مستند می کنیم.
این اطلاعات بعدا مستقیما وارد SOP تولید، مدارک کنترل کیفیت و حتی مستندات رگولاتوری می شود. در صنعت دارویی و واکسن سازی، دقیقا همین سطح مستندسازی است که می تواند تفاوت بین «محصول قابل پذیرش» و «رد شده توسط ارزیاب» را تعیین کند. این مفهوم در چارچوب Quality by Design (QbD) و کنترل ریسک کیفیتی سال هاست پذیرفته شده و تا امروز هم مبنای دفاع صنعتی است.
منابع:
1.Watamura N, Foiani MS, Bez S, Bourdenx M, Santambrogio A, Frodsham C, et al. In vivo hyperphosphorylation of tau is associated with synaptic loss and behavioral abnormalities in the absence of tau seeds. Nat Neurosci. 2025;28:293-307.
2.Cunha DR, Quinaz MB, Segundo MA. Biopharmaceutical analysis — current analytical challenges, limitations, and perspectives. Anal Bioanal Chem. 2025 Aug 12. Epub ahead of print.
3.Tang S, Li Y, et al. Challenges and solutions for the downstream purification of therapeutic proteins. Antib Ther. 2024;7(1):1-12.
4.Hong X, Leung SW, Sik JW, Blakeney V, Magnusson K, Cornish A, et al. The role and pathogenesis of tau protein in Alzheimer’s disease. Biomolecules. 2025;15(6):824.
5.Mahendran TS, Singh A, Srinivasan S, et al. Decoupling phase separation and fibrillization preserves the biochemical activity of tau condensates. bioRxiv [Preprint]. 2025 Mar 19. PMCID: PMC11957012.
6.Oishi Y, Kitatani M, Nakajima K, Ogi H, Kusakabe K. Exploration of the potential energy surface for the conformational interconversion of the amyloid β peptide at the fibril end. arXiv [Preprint]. 2025 May 14;arXiv:2505.09151.
7.Döring S, Weller MG, Reinders Y, Konthur Z, Jaeger C. Challenges and insights in absolute quantification of recombinant therapeutic antibodies by mass spectrometry: an introductory review. Antibodies (Basel). 2025;14(1):3.
8.Montoliu-Gaya L, Foiani MS, Bez S, et al. Plasma tau biomarkers for biological staging of Alzheimer’s disease. Nat Aging. 2025. Epub ahead of print.
9.Lai R, et al. P-tau217 as a reliable blood-based marker of Alzheimer’s disease. Biomedicines. 2024;12(8):1836.
10. This schematic was created using BioRender (Premium).